Как оценивают качество эмбрионов в программах эко?
Содержание:
- День третий
- Полезная информация
- ПГД рекомендовано:
- Техника выполнения ПГД
- Оборудование для проведения безопасного ПГД
- Точность предимплантационной диагностики
- Стоимость преимплантационной генетической диагностики
- Формирование
- Оптимальное количество эмбрионов, рекомендуемое для переноса
- Обследования перед ЭКО
- Классификация бластоцит
- Начало беременности после зачатия
- Одноступенчатые среды
- Классификация эмбрионов по качеству
- Клетки растут в биореакторах объемом несколько тысяч литров
- Выбор оптимального момента для подсадки эмбриона
- Болезнь недоразвития (Runt disease)
- Качество эмбрионов, полученных при экстракорпоральном оплодотворении
- Нужно добиваться разработки этичных технологий
- Перенос
День третий
Нормальный эмбрион на третий день развития имеет от 7 до 9 бластомеров. Он уже начинает выполнять заложенную в нем генетическую программу.
На данном этапе многие зародыши прекращают свое развитие. Это происходит по причине наличия дефектов генетического материала.
«Блок развития» – так называют эмбриологи явление, которое обеспечивает естественный отбор. Процесс размножения весьма сложен. В ДНК часто случаются поломки. «Поломанные» эмбрионы останавливаются в развитии.
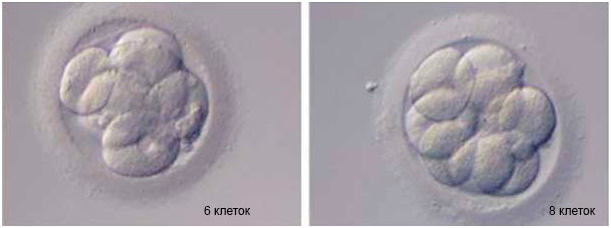
Оценка их качества происходит точно так же, как на второй день. Используется аналогичная классификация. Только бластомеров становится больше. Поэтому описываются они, например, как 8А.
Полезная информация
ПГД рекомендовано:
- При бесплодии, привычном невынашивании беременности
- При неоднократных неудачных попытках ЭКО
- При возрасте женщины старше 35 лет
- При наличии высокого риска передачи наследственных заболеваний
Техника выполнения ПГД
Для проведения преимплантационной генетической диагностики эмбрионам проводится биопсия на 3 день (биопсия бластомера) или на 5 день (биопсия трофэктодермы) их развития.
На третий день развития эмбрион, как правило, состоит из восьми бластомеров (клеток). Биопсия эмбриона на данной стадии представляет собой отделение одной клетки от эмбриона. При этом существует риск повреждения эмбриона, что влечет за собой снижение потенциала его дальнейшего развития. Кроме того, на этой стадии эмбрионы имеют высокий уровень мозаицизма (до 55%), то есть наличия хотя бы одной клетки, отличающейся по хромосомному набору (генетическому составу) от остальных, что обуславливает риск ложнопложительных и ложноотрицательных результатов диагностики.
Более распространенной в современной практике является биопсия эмбриона на пятый день развития. В этот момент эмбрион уже находится в стадии бластоцисты (ранней стадии развития зародыша), состоящей из двух слоев клеток: внутриклеточной массы и трофэктодермы. Впоследствии трофэктодерма участвует в образовании плаценты, а внутриклеточная масса — в образовании плода. В процессе биопсии эмбриолог с помощью микроинструментов забирает сразу несколько клеток трофэктодермы, внезародышевой ткани. Это существенно снижает риск повреждения эмбриона, риск наличия мозаицизма, получения ложноположительных и ложноотрицательных результатов исследования, обеспечивает безопасность процедуры и повышает точность диагностики.
Оборудование для проведения безопасного ПГД
В Доме Планирования Семьи отдается преимущество проведению биопсии эмбрионов на 5 день. Техника проведения такой биопсии требует от эмбриолога значительного опыта и наличия высококлассного оборудования в лаборатории.
Биопсия проводится экспертами-эмбриологами на современном и надежном оборудовании — инвертированном микроскопе Olympus, оснащенном микроманипуляторами Narishige и активным лазером OCTAX NaviLase. При проведении PGD этот лазер позволяет максимально точно и безопасно отделить одну или несколько клеток (биоптат) от эмбриона. OCTAX NaviLase минимизирует вредное воздействие на клетку за счет низкой инвазивности и минимального облучения, и является предметом гордости Эмбриологической лаборатории клиники.
Точность предимплантационной диагностики
Генетический анализ на хромосомный набор может выполняться разными методами, в числе которых метод FISH (флуоресцентная гибридизация in situ), aCGH (метод сравнительной геномной гибридизации) и NGS (метод полногеномного секвенирования). Наша Клиника использует только самые современные методы aCGH и NGS, обеспечивающие информативные и надежные результаты. Слаженная работа команды репродуктологов, эмбриологов и генетиков позволяет достичь высокий процент наступления беременности в Клинике.
Стоимость преимплантационной генетической диагностики
| Название | Цена |
| ПГД методом NGS за каждый образец (30 календарных дней) | 30387 руб. |
| ПГД методом NGS за каждый образец (7 рабочих дней) | 36000 руб. |
| ПГД методом NGS за каждый образец (1,5 рабочих дня) | 39999 руб. |
| Анализ дополнительного образцаот ПГД-эмбриона | 9996 руб. |
Указаны цены на самые востребованные услуги со скидкой 30%, которая действует при оплате наличными или банковской картой. Вы можете обслуживаться по полису ДМС, оплачивать отдельно каждый визит, заключить договор на программу ЭКО или внести депозит. Услуги оказываются на основании заключенного договора.
Принимаются к оплате пластиковые карты MasterCard, VISA, Maestro, МИР. Также доступна бесконтактная оплата картами Apple Pay, Google Pay и Android Pay.
Работаем круглосуточно 24/7
Для Вашего удобства мы работаем 24 часа 7 дней в неделю
Индивидуальный подход ко всем пациентам
Мы учитываем особенности каждого пациента и каждой супружеской пары.
Западные стандарты лечения
Все решения находятся в рамках протоколов доказательной медицины.
Сотрудничество с ведущими клиниками
Наши врачи плотно сотрудничают с коллегами из Европы, США и Израиля.
Формирование
В момент оплодотворения сперматозоидом яйцеклетка превращается в зиготу. Оплодотворения могут проводить в пробирке, либо при помощи вспомогательных методов ИКСИ и ПИКСИ.
В течение первых 24 часов зигота пытается делиться и в конце концов она раздваивается и образуются бластомеры. Уже на этом этапе врач может выбрать качественные эмбрионы, которые не отстают в развитии. Если зигота делится слишком медленно, то это является признаком нарушения.
Эмбрион продолжает активно дробиться, пока не образуется 8 бластомер. На этом этапе могут сформироваться однояйцевые близнецы. Как только бластомеры перестают дробиться, эмбрион превращает в морулу. Следующим этапом внутри эмбриона образуется полость и эмбрион продолжает дробиться, он превращается в бластоцисту из 16 и более клеток.
На этапе бластоцисты зародышу необходимо прикрепиться в полости матки, чтобы начать питаться от организма матери и продолжить расти. Такое состояние наступает на 5 день после оплодотворения.
Оптимальное количество эмбрионов, рекомендуемое для переноса
Как показывает практика, при экстракорпоральном оплодотворении лучше всего переносить в полость матки максимум два эмбриона, при условии, что оба отличаются высоким качеством. Если же качество эмбрионов вызывает сомнения, возможна пересадка трёх эмбрионов.
Некоторые центры по лечению бесплодия практикуют в процессе ЭКО перенос четырёх, и даже пяти эмбрионов. Окончательное решение в этом случае за эмбриологом. Но в последнее время всё больше известных специалистов – как отечественных, так и зарубежных – рекомендуют не подсаживать более 3-х эмбрионов. Ведь, как правило, чаще всего все эмбрионы или приживаются, или погибают.
Подсадка в полость матки большого количества эмбрионов резко увеличивает риск развития в процессе экстракорпорального оплодотворения многоплодной беременности. Поэтому постарайтесь обсудить этот вопрос с вашим доктором.
Обследования перед ЭКО
Перед проведением экстракорпорального оплодотворения обоим родителям назначается комплекс диагностических процедур, целью которых является:
- Определение причины бесплодия у одного или обоих родителей;
- Выявление возможных заболеваний, способных негативно сказаться на эффективности ЭКО или нанести ущерб матери и ее будущему ребенку;
- Оценка вероятности наступления беременности естественным образом и при экстракорпоральном оплодотворении;
- Оценка совместимости генетического материала обоих родителей для исключения резус-конфликта;
- Выбор наиболее эффективного протокола ЭКО, дополнительных репродуктивных технологий для повышения шанса наступления беременности.
Стандартный комплекс диагностики для женщин перед ЭКО включает следующие процедуры:
Анализы крови – клинический, биохимический (на белок, холестерин, мочевину, креатинин и т. д.), гормональный (АМГ, ФСГ, ЛГ и другие), на инфекции (ВИЧ, гепатиты В и С, сифилис, TORCH-комплекс), на резус-фактор и группу крови;
Мазки из цервикального канала и влагалища – микроскопическое исследование, посев на мико- и уреплазму, цитологическое исследование соскоба с шейки матки, исследование на ДНК хламидии, цитомегаловируса, герпесвируса;
Функциональные обследования – флюорография, электрокардиограмма, ультразвуковое исследование щитовидной и паращитовидной желез, органов малого таза, груди, маммография (для женщин старше 35 лет).
Будущий отец также должен пройти стандартный цикл диагностических обследований, включающий:
- Анализы крови – на группу крови и резус-фактор, госпитальный комплекс инфекций (ВИЧ, сифилис, гепатиты В и С);
- Спермограмму – исследование спермы на выявление количества и качества сперматозоидов, их морфологического строения, подвижности и т. д.;
- MAP-тест – исследование спермы на содержание антиспермальных антител, являющихся признаком аутоиммунного бесплодия у мужчин;
- Мазки из уретрального канала – на определение ДНК хламидии, цитомегаловируса, герпесвирусов, для микроскопического исследования отделяемого уретры, посев на мико- и уреплазму.
По результатам обследований врач (гинеколог или андролог) составляет заключение, в котором определяет причину бесплодия, наличие возможных заболеваний у родителей, шанс на успешное наступление беременности. При необходимости он может назначить прохождение дополнительных диагностических процедур для уточнения диагноза.
Классификация бластоцит
Столбец 5, 6 — день переноса и/или криоконсервации (день 5 и 6).
При классификации бластоцист в обозначении указывают цифру от 1 до 6 (степень развития эмбриона):
- полость бластоцисты меньше, чем половина целого эмбриона
- полость бластоцисты больше, чем половина целого эмбриона
- полная бластоциста, полость заполняет почти весь эмбрион
- развитая бластоциста, полость включает весь эмбрион, тонкая оболочка
- бластоциста пробивается из оболочки
- бластоциста без оболочки
Буквенное обозначение
Качество внутриклеточной массы, из которой будет развиваться зародыш:
- A — много клеток, плотно упакованные
- B — несколько клеток, свободно сгруппированные
- C — очень немного клеток
Качество трофэктодермы (TE), которая обеспечит прикрепление эмбриона к эндометрию и разовьется в плаценту
- A — много клеток, образуют единый слой
- B — мало клеток, образуют свободный эпителий
- C — очень мало крупных клеток
Начало беременности после зачатия
После проникновения сперматозоида в яйцеклетку образуется зигота — оплодотворенная яйцеклетка, одноклеточная стадия развития эмбриона. У человека стадия зиготы продолжается первые 26-30 часов развития. Зигота приступает к формированию ядер.
Сперматозоид проникает в яйцеклетку, когда она находится на стадии второго деления мейоза (после овуляции мейоз в яйцеклетке останавливается на стадии метафазы II и возобновляется после проникновения сперматозоида). Зигота завершает мейоз и как следствие выделяет 2-е полярное тельце и формирует женский пронуклеус (женское ядро).
Параллельно из материала ядра сперматозоида зигота формирует мужской пронуклеус (мужское ядро). Каждый из пронуклеусов зиготы имеет одинарный (гаплоидый) набор хромосом, в мужском пронуклеусе располагаются отцовские хромосомы, в женском пронуклеусе — материнские хромосомы. В микроскоп пронуклеусы в зиготе становятся видны спустя 13-15 часов после проникновения сперматозоида и исчезают спустя 20-21 час после проникновения сперматозоида. Сформировавшись на разных концах зиготы, пронуклеусы движутся навстречу друг другу (так называемое «сближение пронуклеусов»), после чего их оболочки растворяются и хромосомы выстраиваются в метафазную пластинку первого деления митоза. Таким образом, объединение отцовских и материнских хромосом происходит на стадии метафазы митоза зиготы. В отличие от зиготы иглокожих, в зиготе человека и других позвоночных животных не наблюдается слияния пронуклеусов с образованием единого ядра зиготы.
Одноступенчатые среды
Для культивирования эмбрионов в клинике используются передовые одноступенчатые среды, которые позволяют «оставить в покое» эмбрионы до 5го дня развития.
Через сутки эмбрион уже состоит из 6–8 бластомеров. До этого момента эмбрион развивался исключительно на материнских «запасах», накопленных в яйцеклетке за время ее роста и развития в яичнике. Однако если «генетическая программа», в которой закодированы этапы нормального развития эмбриона, содержит ошибки, эмбрион (4–19% случаев) останавливается в развитии не достигнув стадии бластоцисты — так называемый «блок развития». Это природный процесс отбора генетически нормальных эмбрионов.
Наиболее точная (эффективная) оценка эмбрионов происходит на стадии бластоцисты (5–6 день после оплодотворения). И если «лучшая» бластоциста выросла из «худшего» ооцита, максимальные шансы на успешное ЭКО будут все‐таки у нее. Поэтому, уважаемые пациенты, не стоит узнавать ежедневно судьбу каждого эмбриончика. Наберитесь терпения, скоро все станет предельно ясно!
Эмбриологи используют численно–буквенную систему оценки качества, где первая цифра означает количество бластомеров, буква их качество, а вторая цифра оценка фрагментации.
- Тип A1 — эмбрион с равными бластомерами, отличного качества без ануклеарных (безъядерных) фрагментов (например, 4А1 — четырех клеточный «отличник»).
- Тип В2 — эмбрион хорошего качества с содержанием ануклеарных фрагментов до 20% (4В2)
- Тип С — эмбрион удовлетворительного качества с содержанием ануклеарных фрагментов от 21% до 50% (4С3)
- Тип D — эмбрион неудовлетворительного качества с содержанием ануклеарных фрагментов более 50% (4D4)
Классификация эмбрионов по качеству
Классификаций эмбрионов по качеству существует много, но преимущественно используют две классификации: для оценки трехдневных и пятидневных эмбрионов.
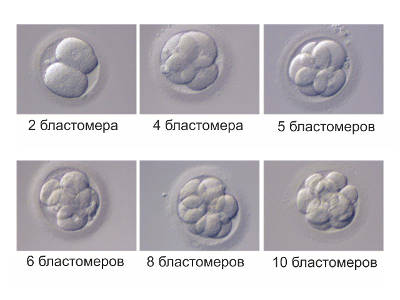
Классификация трехдневных (и двухдневных) эмбрионов происходит по количеству клеток (соответствие дню развития) и степени фрагментации.
| 0 – день пункции | Нормальное количество бластомеров | Класс (тип) эмбриона по степени фрагментации | Процент фрагментации | Характеристика, качество эмбриона |
| 2 сутки | 2-4 | A | Отсутствует | Отличное, без фрагментации |
| 3 сутки | 4-10 | B | До 25% | Хорошее, с содержанием безъядерных фрагментов |
| 4 сутки | более 8, чаще 10-16 | C | 25-50% | Удовлетворительное (среднее), с фрагментацией |
| D | Более 50% | Неудовлетворительное, низкое с высокой степенью фрагментации |
Запись выглядит так: 6А, 4B, 4C, где цифра – количество клеток, а буква соответствует степени фрагментации. Расшифровывается аббревиатура так: класс 6A – шестиклеточный эмбрион отличного качества без фрагментации, класс 4B – четырехклеточный эмбрион хорошего качества с содержанием безъядерных элементов, класс 4C – четырехклеточный эмбрион удовлетворительного качества с фрагментацией.
Клетки растут в биореакторах объемом несколько тысяч литров

Культивирование клеток в биореакторе. Фото с сайта process-worldwide.com
В медицине и фармакологии эмбриональные клеточные линии в настоящее время используются при создании вакцин (векторных или живых) от кори, краснухи, паротита, гепатита А, бешенства, ветряной оспы, коронавируса. Человеческие клеточные линии нужны для размножения вируса, который потом используют в прививке. Ведь вирусам, в отличие бактерий, нужен «хозяин», и этим «хозяином» становятся клетки клеточной линии.
Их также используют для создания лекарственных препаратов от ревматоидного артрита, гемофилии и муковисцидоза. Кроме того, линию НЕК-293 применяют в исследованиях, посвященных поиску раковых терапий. На ней же выращивают адено-ассоциированный вирус, который служит вектором для доставки генов в препарате «Золгенсма», который применяют при терапии спинально-мышечной атрофии.
Эмбриональные клетки действительно могут делиться практически бесконечно в условиях, созданных для этого в лабораториях. Сторонники этого метода в качестве аргумента, оправдывающего использование абортивного материала, говорят: клеточные культуры, которые используются сегодня, получились в результате длительного деления и уже фактически не являются частью организма некогда абортированного ребенка.
Получение клеточной линии выглядит следующим образом. Ткань или орган, из клеток которых предстоит в будущем развивать клеточную линию, забирают с соблюдением условий асептики, помещают в стерильный солевой раствор и транспортируют в специализированную лабораторию.
В лаборатории ткани и органы тщательно изучают, в том числе на предмет возможного инфицирования. Если установлено, что они «чистые», скальпелем или ножницами измельчают до кусочков размерами не более 1-3 мм, тщательно отмывают от клеток крови в нескольких сменах стерильных растворов, а затем помещают в растворы специальных ферментов, позволяющих изолировать отдельные клетки.
Собственно, эти самые клетки, которые удается выделить с помощью измельчения (иногда для этого даже может понадобиться своеобразное «сито», через которое фильтруют полученный из тканей или органов раствор) – это и есть первичная клеточная культура. Ее можно начинать «растить» с помощью питательной среды и ряда специальных технологий.
Большинство клеточных культур растут в так называемом монослое – то есть на дне пластикового или стеклянного контейнера, располагаясь слоем толщиной в одну клетку. Чтобы они размножались быстрее и эффективнее, были придуманы специальные многоэтажные контейнеры. (Вот так например это выглядит. )
Некоторым типам клеток требуется постоянное перемешивание – для них были изобретены «шейкеры», которые встряхивают сосуды с клетками. Например, в Италии для создания вакцин в заводских условиях используют одновременно 28 тысяч особых роллерных флаконов. Автоматика при этом контролирует температуру и скорость вращения. А когда на заводе заменили гладкие стеклянные флаконы на гофрированные из пластика, увеличив площадь поверхности, получили двадцатикратный прирост клеток, а удвоение клеточной популяции происходит всего за 8 с небольшим часов.
Но лучше всего работает технология, при которой клетки размножаются в виде суспензии в специальном биореакторе. Такие реакторы объемом до 8 тысяч литров работают в странах Европы и в США.
При этом, собственно клетки эмбриональной линии в конечный продукт (прививку) попадать не должны.
Когда вирус размножится в достаточном количестве, его разными средствами отделяют от клеточной культуры, очищают от примесей. Для этого могут использовать разные методы – электрофорез, различные химические вещества, окрашивание и даже многоуровневая фильтрация. Полученный же чистый вирус или его фрагменты добавляют в вакцину вместе с другими веществами, которые обеспечат ее консервацию, стабильность и в дальнейшем – необходимое воздействие на организм.
Выбор оптимального момента для подсадки эмбриона
Как правило, в клиниках по лечению бесплодия практикуется подсадка эмбриона на вторые или третьи сутки после культивирования. На практике не было выявлено существенного влияния на результат беременности при переносе на вторые или на третьи сутки. Момент выбирают, исходя из анализа интенсивности, а также равномерности дробления эмбрионов. В случае, если на вторые сутки выбор сделать не получается – подсадка выполняется на следующий день.
Пациентке советуют предварительно позвонить в центр по лечению бесплодия и уточнить, как происходит оплодотворение яйцеклетки. Врач сообщает, когда ей следует подойти для процедуры переноса эмбрионов в матку.
Болезнь недоразвития (Runt disease)
Этот экспериментальный синдром был создан введением незрелому плоду или новорожденному иммунокомпетентных аллогенных клеток взрослого донора, отличных от донора антигенами главного комплекса тканевой совместимости. Введенные реципиенту клетки вызывают внутриутробную смерть и изгнание плода. При этом у новорожденного обнаруживают целый комплекс изменений, как то: недоразвитие, понос, повреждения кожи и шерсти, первоначальная гипертрофия, а затем полная инволюция лимфоидной системы, очаги некроза в печени, селезенке, вилочковой железе. Введение лимфоцитов отцовской линии взрослым гибридным мышам первого поколения вызывает развитие иммунодефицита. Болезнь недоразвития со своими различными вариантами является характерным примером реакции трансплантата против хозяина, когда способные на иммунную реакцию клетки вводятся в чужой организм, неспособный защититься от такой агрессии.
В рамках недавно проведенных исследований удалось вызвать развитие такого синдрома у 57% детенышей самок крыс, сенсибилизированных до беременности к отцовским тканевым антигенам. Сенсибилизацию проводили либо введением лимфоидных клеток после применения циклофосфамида, либо кожным трансплантатом, причем в обоих видах эксперимента ткань для трансплантата брали у животных той линии, с которой в дальнейшем проводилась случка, и которые отличались от матери по антигенам главного комплекса гистосовместимости. Наиболее тяжелые для крысят последствия наблюдались тогда, когда иммунизация матери проводилась за неделю до случки, с таким расчетом, чтобы максимальная сенсибилизация совпала как можно точнее с имплантацией бластоцист. Трансплантаты аллогенных лимфоидных клеток сильнее индуцировали гуморальный иммунитет, чем пересаженная кожа. При этом коэффициент частоты болезни недоразвитости находился в зависимости от численности пересаженных иммунокомпетентных клеток.
В нормальных условиях болезнь недоразвитости не развивается, вероятно, по причине способности плода к сроку родов разрушать, не сенсибилизируясь, небольшое количество лимфоцитов матери, проникающих через плацентарный барьер. Об этом говорит и тот факт, что у страдающих лейкозом беременных, новорожденные лейкозом не страдают, несмотря на то, что меченые лейкоциты матери обнаруживаются в плаценте и в крови пуповины. Плод разрушает лимфоциты матери. Тем не менее, согласно результатам недавно проведенных исследований, в отдельных случаях нельзя исключить развитие болезни у детей. Так, были отмечены случаи развития болезни недоразвитости при попытке лечения иммунодефицитов у грудных детей с дисплазией вилочковой железы и другими нарушениями, которым проводились пересадка костного мозга, трансфузия лейкоцитарной массы, а также переливание эритроцитарной массы без удаления из нее лейкоцитов в тяжелых случаях резус-сенсибилизации. Однако часто на данную патологию без достаточных оснований и «списывали» необъяснимые случаи летальных исходов у грудных детей, страдающих лимфоцитарным химеризмом, поражениями кожи и лимфоидных органов, а также некоторые случаи выкидышей, антенатальной смерти плода и гипотрофии плода.
В заключение нужно сказать, что роль иммунных механизмов в патогенезе отдельных осложнений беременности пока недостаточно выяснена. И если при некоторых патологических состояниях, таких как изоиммунизация матери к эритроцитарным антигенам, в частности к агглютининогену D, участие иммунных механизмов точно установлено, то этого нельзя сказать о выкидыше и позднем токсикозе, где можно говорить в основном о гипотезах. Уточнение роли нарушений иммунных взаимоотношений матери и плода в патогенезе тех или иных осложнений беременности станет возможным только после подробного выяснения механизмов, защищающих фето-плацентарный трансплантат.
Теги:
иммунология репродукции
Качество эмбрионов, полученных при экстракорпоральном оплодотворении
Условная оценка
класс 1 (А) — отлично
— максимальная скорость дробления;
— отсутствие фрагментов без ядер;
— бластомеры идеальной формы;
— отличная способность к имплантации в процессе ЭКО.
На картинке:
1)двухклеточный эмбрион 1-го класса;
2) четырёххклеточный эмбрион 1-го класса;
3) пятиклеточный эмбрион 1-го класса;
4)восьмиклеточный эмбрион 1-го класса;
5)двенадцатиклеточный эмбрион 1-го класса.
класс 2 (В) — хорошо
— бластомеры, полученные в результате оплодотворения яйцеклетки, неровной формы, либо присутствие фрагментов цитоплазмы также неровной формы, при их количестве не более 10% от общего объёма;
— отличная способность к имплантации.
1)двухклеточный эмбрион 2-го класса;
2) пятиклеточный эмбрион 2-го класса;
3) четырёххклеточный эмбрион 2-го класса;
4)восьмиклеточный эмбрион 2-го класса.
класс 3 (С) – удовлетворительно
— фрагментация, составляющая от 10 до 50% от общего объёма
1) шестиклеточный эмбрион 3-го класса;
2) восьмиклеточный эмбрион 3-го класса.
Нужно добиваться разработки этичных технологий

Фото: invest.mosreg.ru
Вопрос этичности вакцин и их связи с абортивными материалами не раз поднимался представителями разных конфессий.
В декабре 2020-го Ватикан заявил, что «в отсутствии альтернативы использование вакцин, произведенных с применением клеточных линий от абортированных эмбрионов, нравственно допустимо, и следует иметь в виду, что отказ от вакцинации по причине неприятия подобных вакцин «может увеличить риски для общественного здоровья».
Официальной позиции Русской Православной Церкви по поводу использования вакцин от коронавируса, которые так или иначе связаны с эмбриональными клеточными линиями, пока нет. Известно, что соответствующие запросы были направлены всем разработчикам российских вакцин, и представители института им. Гамалеи подтвердили, что использовали клеточную линию HEK293 для культивации аденовируса, но при этом подчеркнули, что в конечном продукте абортивных клеток нет, а создатели «ЭпиВакКороны» поспешили заверить, что их вакцина максимально этична.
В настоящее время Церковь в решении этого вопроса отсылает к двум документам. Прежде всего это «Основы социальной концепции» , которая говорит: «Осуждая аборт как смертный грех, Церковь не может найти ему оправдания и в том случае, если от уничтожения зачатой человеческой жизни некто, возможно, будет получать пользу для здоровья».
С другой стороны, в 2009 году, когда разгорелись аналогичные споры по поводу вакцинации от кори, российское Общество православных врачей выступило с заявлением, где признается возможным временное использование вакцин, при разработке которых используется абортивный материал, но говорится следующее: «Вместе с тем мы считаем необходимым решительно высказаться в пользу применения альтернативных (этических) вакцин при их наличии. Необходимо также добиваться от Правительства России, Министерства здравоохранения и социального развития, а также фармацевтической промышленности создания отечественных альтернативных (этических) вакцин или приобретения в странах, их производящих».
Перенос
Перенос эмбрионов может проводиться не только на 5 сутки на стадии бластоцисты. В некоторых случаях может быть рекомендован более ранний перенос — на 3 сутки.
Культивирования эмбриона до стадии бластоцисты позволяет выбрать максимально качественные клетки, так как многие из них погибают в искусственных условиях. Подсадка качественных эмбрионов увеличивает шанс наступления беременности.
Но если женщина уже несколько раз неудачно прошла ЭКО с пятидневными бластоцистами, ей может быть рекомендован перенос трехдневных эмбрионов. Возможно, что им будет легче развиваться в естественных условиях и они выживут, сформировав здорового ребенка.
Стоит отметить, что классификация эмбрионов при ЭКО не является приговором. Даже если были получены эмбрионы плохого качества, беременность все равно может наступить. Часто врачи встречаются с ситуацией, когда женщина не может забеременеть с первоклассными бластоцистами. Но при переносе эмбрионов 3 класса беременность успешно наступала и рождался здоровый ребенок.